2 月 8 日,中心曹罡教授課題組在Neuron發表文章 Neuron-derived neuropeptide Y fine-tunes the splenic immune responses,發現神經系統感知病原感染,上調神經肽 NPY 基因表達,精細調控機體免疫應答反應的新機制,揭示了神經源性的 NPY/F 是介導神經系統和免疫系統交流的一種「古老語言」。該研究被審稿人稱贊為「tour de force」(英語中的法語外來詞,意為 an exceptional achievement by an artist)。
生物從單細胞生物進化到多細胞生物的一個重要優勢是不同類型的細胞或器官能夠分工與合作,通過不同方式「交流溝通」,從而更加高效地完成復雜的生理任務。其中,機體神經系統與免疫系統的互作近年來受到極大關注,神經系統與免疫系統的相互影響、調控已成為深入研究生理與病理狀態下免疫系統調節機理的重要切入點。
特定神經系統的免疫調節功能極有可能為多種免疫疾病的治療提供全新的治療思路。但神經系統如何感知病原感染與免疫響應?又如何與免疫系統進行「交流溝通」,從而精細調控免疫響應?這些神經-免疫系統之間「交流溝通」的語言在進化中是否保守?這些問題到目前為止仍知之甚少,極大地限制了對神經免疫調控機制的理解,又阻礙了相關疾病(如炎癥風暴、自身免疫疾病)的治療策略的開發和應用。
本研究首先利用偽狂犬病毒逆行追蹤驗證腎上-腹腔神經節(SrG-CG)到脾臟的神經通路。通過對 SrG-CG 的 RNA-seq 測序分析發現大鼠 SrG-CG 中含有豐富的 NPY+神經元。且 NPY 是所有神經遞質中對 LPS 處理響應變化最顯著的基因。
隨后研究人員通過鈣成像實驗,發現 LPS 可以直接激活 SrG-CG 神經元,同時大鼠 SrG-CG 神經元中的 LPS 受體 TLR4 與 NPY 的表達存在共定位現象。這些結果顯示 LPS 可以直接激活腎上-腹腔神經節并上調 NPY 的表達水平,這一過程可能在調節脾臟免疫應答反應中發揮重要功能(圖 1)。
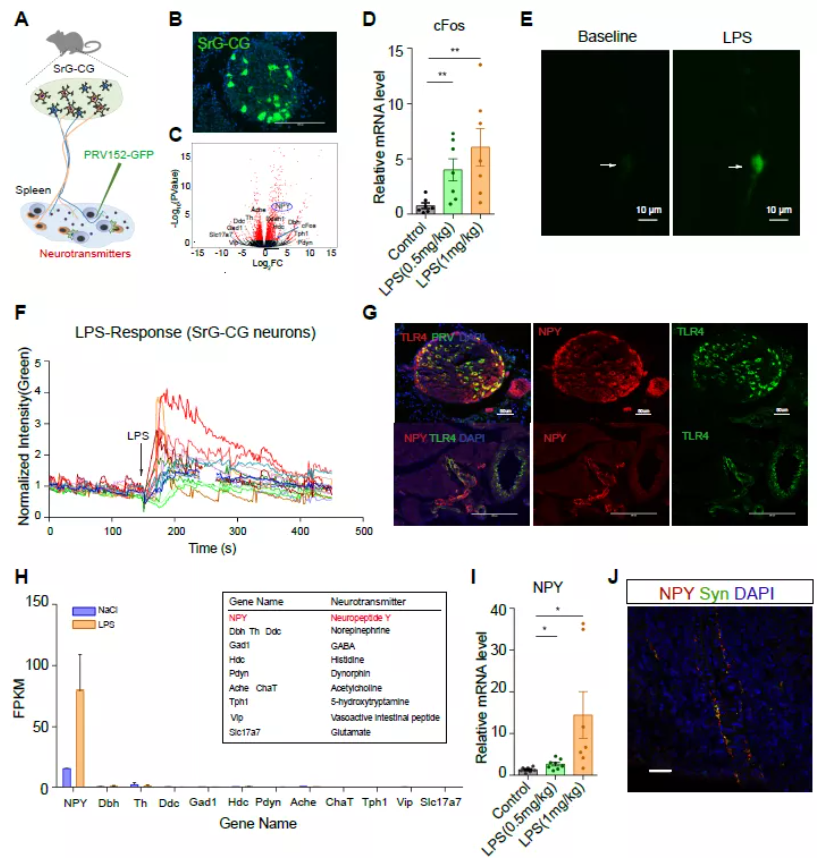
圖 1. LPS 激活 SrG-CG 神經節,誘導 NPY 基因的表達
為進一步研究 SrG-CG 神經元分泌的 NPY 對脾臟的免疫調節作用,研究人員構建了具有敲降 NPY 功能的腺相關病毒,發現大鼠在敲降 SrG-CG 神經元中 NPY 水平后,脾臟中 T 細胞、B 細胞和巨噬細胞的功能均發生了變化。scRNA-seq 測序分析和免疫組化結果顯示:T 細胞和巨噬細胞上含有豐富的 NPY 受體 NPY1R,可以直接與 NPY 進行對話,而 B 細胞沒有 NPY1R。同時 NPY 作用于巨噬細胞會抑制巨噬細胞的 TNF 信號通路,減少脾臟巨噬細胞中 IL-1β、TNF-α 等細胞因子的含量。
為了進一步解釋機體遭遇系統性炎癥時 SrG-CG NPY+神經元發揮的功能,通過體外 NPY 刺激脾細胞,SrG-CG 神經元與脾細胞共培養,體內 SrG-CG 神經元 NPY 敲降及過表達實驗,研究人員發現在 LPS 誘導的大鼠炎癥模型中,SrG-CG 神經元中 NPY 主要表現為抑制脾臟炎癥風暴的功能。
NPY 在物種進化過程中具有極強的保守性,研究人員猜測 NPY 在免疫調節中的作用也極有可能是保守的。研究發現果蠅中神經源性 NPF(NPY 同源物)與大鼠 NPY 功能類似,能夠顯著降低果蠅中細菌感染誘導產生的抗菌肽及細胞因子的水平。由此表明 NPY 對機體免疫系統的調控在進化上是保守的,機體神經系統與免疫系統的交流是低等動物到高等動物的共同特征,而神經肽(如 NPY 等)則是維系這種溝通的古老語言。
NPY 在機體免疫調節中的發揮著重要功能,那它們與人類自身免疫疾病的發生發展是否存在關聯?通過對自身免疫疾病患者(如風濕性關節炎,紅斑狼瘡等)的血液樣本分析發現自身免疫疾病患者血清中 NPY 蛋白含量明顯減少。為進一步探索 NPY 與自身免疫疾病的關系,研究人員構建了小鼠關節炎模型,發現敲降 SrG-CG 的 NPY 水平,會使小鼠關節炎癥狀加劇(圖 2)。因此,外周神經遞質紊亂(如 NPY)可能是誘發自身免疫疾病發生的原因之一,將 NPY+神經元作為新的藥物靶點或開發相關的短肽藥物,可能是治療自身免疫疾病的新思路。
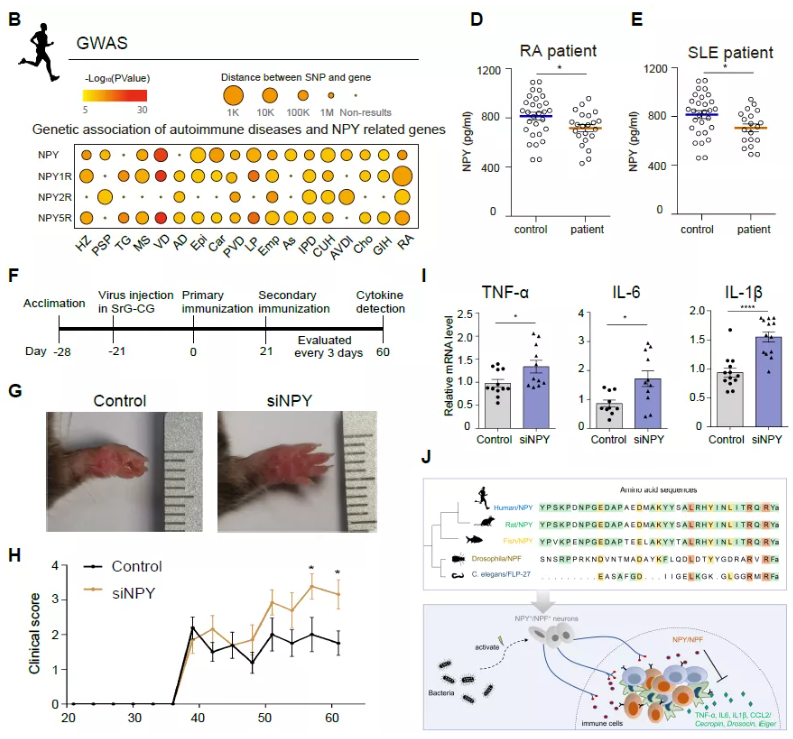
圖 2. NPY 在抑制自身免疫疾病中的作用
綜上所述,曹罡教授團隊揭示了神經來源的 NPY/F 是神經系統和免疫系統「交流」的一種古老語言,從果蠅、小鼠、大鼠到人都是保守的,神經系統能夠感知病原感染,大量上調 SrG-CG 的 NPY 表達,從而發揮免疫應答的精細調控作用(圖 2)。NPY/F 可能用于緩解感染期間引起的炎癥風暴和調節自身免疫疾病中的免疫平衡,并對自身免疫疾病的新藥物靶點和短肽藥物開發提供新思路。
中心曹罡教授為本文的通訊作者,博士生余勁松和肖珂博士為本文共同第一作者,本研究還得到了華中農業大學戴金霞博士、上海科技大學胡霽教授、華中科技大學同濟醫學院郭崢教授,武漢中部戰區總醫院陳曉華博士和哈佛醫學院馬秋富教授的大力支持。
【Summary】
The nervous and immune systems are closely entwined to maintain the immune balance in health and disease. Here, we showed that LPS can activate suprarenal and celiac ganglia (SrG-CG) neurons and upregulate NPY expression in rats. Single-cell sequencing analysis revealed that knockdown of the NPY gene in SrG-CG altered the proliferation and activation of splenic lymphocytes. In a neuron and splenocyte coculture system and in vivo experiments, neuronal NPY in SrG-CG attenuated the splenic immune response. Notably, we demonstrated that neuronal NPF in Drosophila exerted a conservative immunomodulatory effect. Moreover, numerous SNPs in NPY and its receptors were significantly associated with human autoimmune diseases, which was further supported by the autoimmune disease patients and mouse model experiments. Together, we demonstrated that NPY is an ancient language for nervous-immune system crosstalk and might be utilized to alleviate inflammatory storms during infection and to modulate immune balance in autoimmune diseases.
文章鏈接:https://doi.org/10.1016/j.neuron.2022.01.010