近日,中心晏向華教授課題組揭示了亮氨酸調控mTORC1通路的機制,為營養物質尤其是亮氨酸調控mTORC1的機制提供了理論依據。相關研究成果以“KAT7-mediated CANX (calnexin) crotonylation regulates leucine-stimulated MTORC1 activity”為題在Autophagy發表。
mTORC1作為機體感應營養物質尤其是氨基酸最重要的信號通路之一,通過其激酶活性磷酸化不同底物,參與多種下游的生理及病理過程。氨基酸通過調控mTORC1的溶酶體定位進而影響其激活過程,迄今為止已有多個重要的調控蛋白或蛋白復合體在溶酶體表面調節mTORC1的溶酶體移位,但是否還有新的調控蛋白參與此過程仍舊未知。晏向華課題組在前期成功構建了受亮氨酸調節的mTORC1激活過程中的體外無細胞體系。
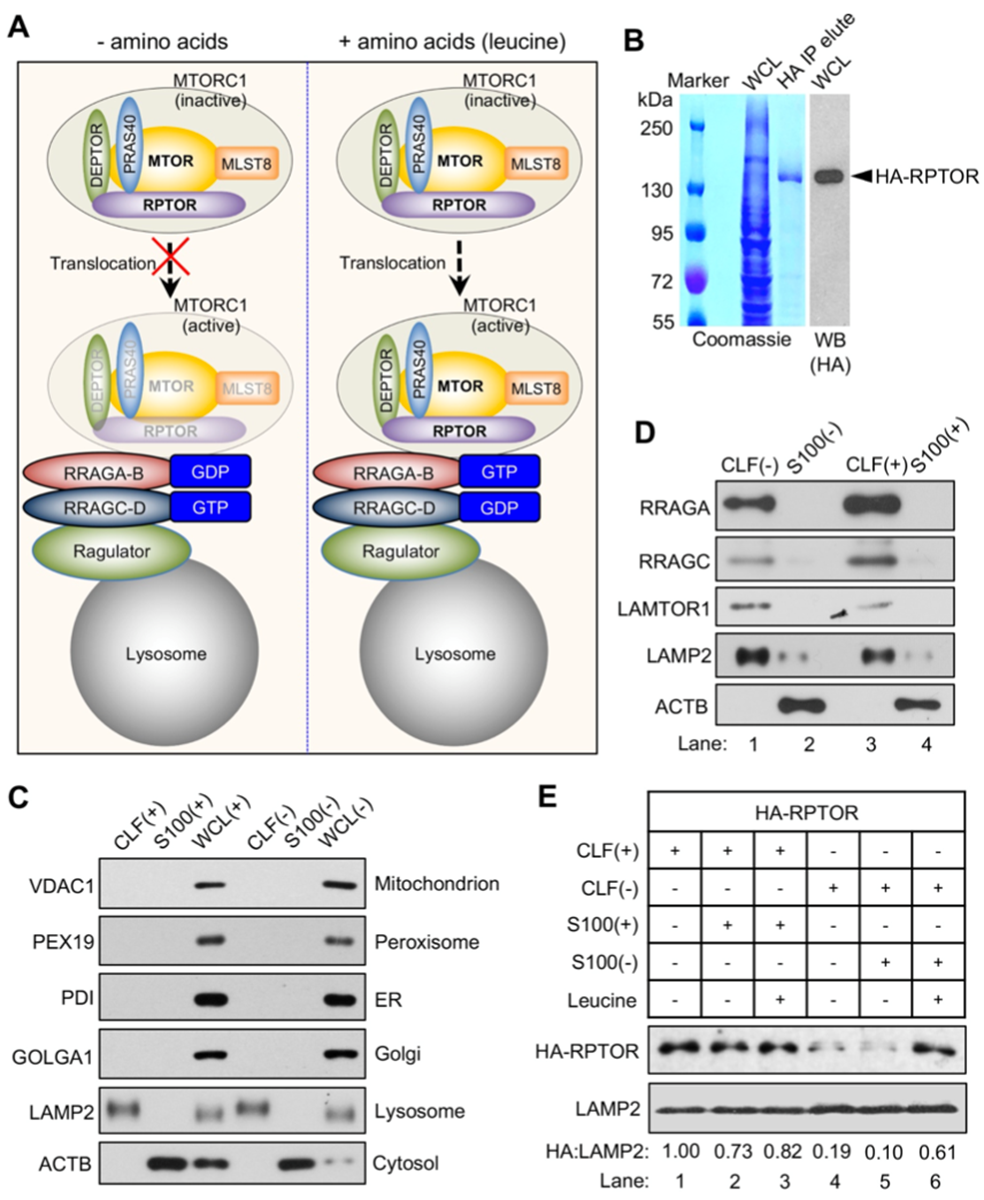
圖1.受亮氨酸調節的mTORC1通路體外無細胞體系的構建
在體外無細胞體系的基礎上,研究人員在整體蛋白質組范圍內大規模地分析了亮氨酸調控的溶酶體移位的蛋白質。試驗成功鑒定到已被報道的亮氨酸感受體蛋白SESN2,在此基礎上,發現鈣調蛋白Calnexin可能在亮氨酸缺失后移位至溶酶體組分。研究團隊在后續綜合運用基因編輯、亞細胞分離、免疫熒光等實驗,確認了Calnexin參與亮氨酸調控mTORC1激活的過程,并揭示了亮氨酸缺失后Calnexin移位至溶酶體表面與溶酶體膜蛋白LAMP2結合的機理。結合課題組前期的一項巴豆酰化比較蛋白質組的結果,研究團隊發現并證明了乙酰轉移酶KAT7能夠催化Calnexin的巴豆酰化修飾,進而調節Calnexin的溶酶體移位過程。最后與已知的mTORC1調控蛋白進行關聯分析,發現移位至溶酶體表面的Calnexin抑制了Ragulator復合體對Rag GTPase的GEF活性進而抑制了mTORC1的溶酶體移位。
此外,該研究鑒定到了多個亮氨酸調控mTORC1過程中的新調控蛋白,并首次證明了新型蛋白質Calnexin翻譯后修飾-賴氨酸巴豆酰化修飾-參與調控mTORC1的活性。
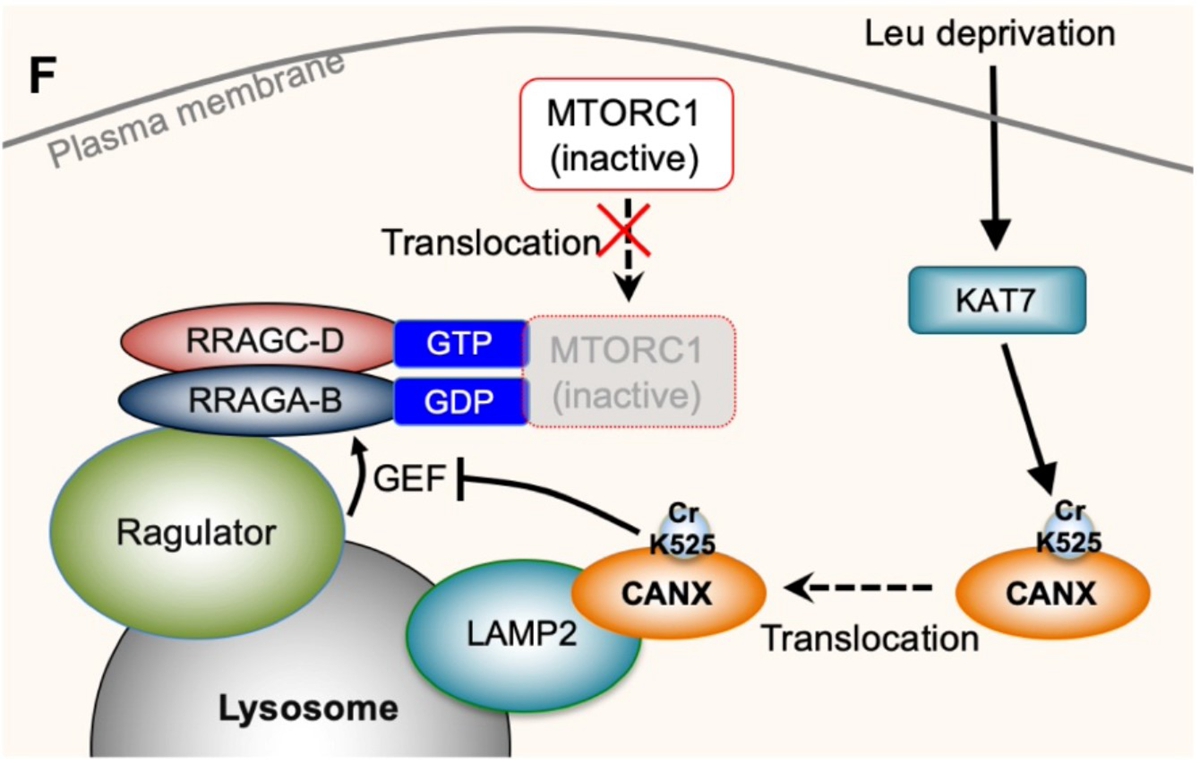
圖2. KAT7介導的CANX巴豆酰化調控mTORC1的機制
中心晏向華教授為論文通訊作者,博士研究生嚴國楷(現為北京大學博士后)和李秀芝(現為上海交通大學博士后)為本文共同第一作者,本研究還得到了上海交通大學鐘清教授、南京農業大學朱偉云教授、武漢大學周蕊教授和中山大學崔雋教授的支持。
【英文摘要】
Amino acids play crucial roles in the MTOR (mechanistic target of rapamycin kinase) complex 1 (MTORC1) pathway. However, the underlying mechanisms are not fully understood. Here, we establish a cell-free system to mimic the activation of MTORC1, by which we identify CANX (calnexin) as an essential regulator for leucine-stimulated MTORC1 pathway. CANX translocates to lysosomes after leucine deprivation, and its loss of function renders either the MTORC1 activity or the lysosomal translocation of MTOR insensitive to leucine deprivation. We further find that CANX binds to LAMP2 (lysosomal associated membrane protein 2), and LAMP2 is required for leucine deprivation-induced CANX interaction with the Ragulator to inhibit Ragulator activity toward RRAG GTPases. Moreover, leucine deprivation promotes the lysine (K) 525 crotonylation of CANX, which is another essential condition for the lysosomal translocation of CANX. Finally, we find that KAT7 (lysine acetyltransferase 7) mediates the K525 crotonylation of CANX. Loss of KAT7 renders the MTORC1 insensitivity to leucine deprivation. Our findings provide new insights for the regulatory mechanism of the leucine- stimulated MTORC1 pathway.
論文鏈接:https://www.tandfonline.com/doi/full/10.1080/15548627.2022.2047481